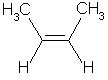
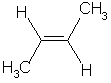
| Z-but-2-ène | E-but-2-ène |
 |
 |
(page2)
Lecture sur Netscape conseillée
N.B. Pour ce chapitre vous utiliserez un
système de visualisation de modèles moléculaires appelé CHIME
qui offre de nombreuses possibilités d'animation.
- Pour faire tourner la molécule: bouton
gauche de la souris appuyé
- Pour zoomer la molécule (avant ou arrière): bouton
gauche appuyé + touche
majuscule (shift)
- Pour appeler le menu contextuel, très riche: bouton
droit de la souris.
Rappel: l'éthène ou éthylène de formule brute C2H4 est la molécule la plus simple de la famille des alcènes. Ceux-ci sont des hydrocarbures possédant une double liaison C=C.
Formule brute C4H8
Formule semi-developpée CH3-CH=CH-CH3 (la double liaison C=C est entre le carbone n°2 et le carbone n°3)
Il existe deux façons (et seulement deux) de disposer les groupes CH3 et les atomes H autour de la double liaison C=C
| Z-but-2-ène | E-but-2-ène |
 |
 |
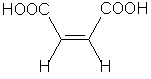
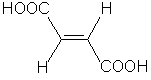
| Nom officiel et nom courant | acide Z-butènedioïque ou acide maléique | acide E-butènedioïque ou acide fumarique |
 |
 |
|
| Température de fusion | 130°C | 287°C |
| Solubilité dans l'eau | 790 g.L-1 | 7 g.L-1 |
| Constantes d'acidité | pKa1 = 2,0 et pKa2 = 6,2 | pKa1 = 3,0 et pKa2 =4,4 |
Possibilité de deux diastéréoisomères: l'isomère Z (zusammen: ensemble) et l'isomère E (entegegen: opposé)
Considérons une molécule de bromochlorofluorométhane CHBrClF. Les quatre atomes liés au carbone sont différents.
Considérons maintenant une molécule de 3-éthyl-3-méthyl-octane C3H7-C*(C2H5)(CH3)-C4H9. Les quatre groupes d'atomes (on dit substituants) autour du carbone marqué d'un * sont différents.
Dans les deux cas, les atomes de carbone considérés sont entourés de quatre substituants différents. On dit qu'ils sont asymétriques.
|
|
|
Autres exemples de molécules à carbone asymétrique: écrire leur formule semi-développée en mettant en évidence le C*
Acide 2-hydroxypropanoïque ou acide lactique
Alanine (un acide a aminé)
Leucine (un autre acide a aminé)
sucres du type glucose, galactose, fructose ...
Considérons, par exemple, les modèles moléculaires du bromochlorofluorométhane. On constate que l'on peut construire deux modèles différents et seulement deux. Tout autre modèle que l'on voudrait construire est nécessairement identique à l'un des deux premiers que l'on peut observer ci-dessous.
| (R)-bromochlorofluorométhane | (S)-bromochlorofluorométhane |
Pour passer d'une molécule à l'autre, il faut casser deux liaisons (par exemple C-Cl et C-Br), inverser les positions des atomes substituants (Cl et Br) et reconstruire deux liaisons (C-Br et C-Cl). Il s'agit donc bien de deux stéréoisomères.
On dit que ce sont deux énantiomères.
Redisons le: on peut essayer toutes les combinaisons, on ne trouvera que deux énantiomères.
Conséquence: 1 C* Û 2 énantiomères
Deux énantiomères sont images l'un de l'autre dans un miroir.
| (R)-2-chlorobutane | (S)-2-chlorobutane |
On dit de ces molécules qu'elles sont chirales (mot dont la racine est d'origine grecque: kheir, la main, que l'on retrouve dans chiropractie, chiroptère, chiromancie). En effet, elles sont comme les deux mains d'un individu, symétriques l'une de l'autre par rapport à un plan.
Remarques:
de nombreux objets sont chiraux: mains, gants, tire-bouchon, casserole à bec verseur ...)
si le C n'est pas asymétrique, il n'y a pas
chiralité. Exemple avec le bromochlorométhane. 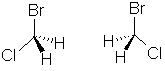
Ces deux molécules sont identiques. Il suffit, pour s'en convaincre d'en
faire tourner une de 180° autour de l'axe vertical C-Br. On notera que,
dans cette molécule, il existe un plan de symétrie, le plan vertical qui
contient les trois atomes Br, C et Cl. Le carbone central est donc, ici,
"symétrique". Cette dernière observation explique le
qualificatif d'asymétrique donné à un carbone doté de quatre
substituants différents.
Certaines propriétés peuvent être identiques: Température d'ébullition, température de fusion, densité, solubilités ...
Elles sont souvent différentes:
- Propriété physique: action sur la lumière
polarisée,
- les propriétés chimiques sont différentes:
- l'odeur
(ex: le citronellol dont l'un des énantiomères sent la citronelle,
l'autre le géranium)
- le
goût( ex: l'aspartame qui a un goût sucré -d'où son utilisation comme
édulcorant- alors que son énantiomère a un goût amer)
- la
réactivité dans les réactions catalysées (voir rôle des enzymes, d'où
importance en biologie).